基礎知識
商品紹介
専門情報
参考資料
コラーゲンを変形させずに抽出されたもの。ハーバード大学の研究では、Ⅱ型の非変性コラーゲンが免疫寛容によって関節の炎症が抑えられることがわかっている。シニア向けの健康食品として摂取されている。原料として、主に鶏の軟骨であったが、『近年アルカリ溶液による抽出方法の発見と、サケの鼻軟骨を原料とすることにより、生産の低コスト化が実現した。』(ウィキペディア)
Ⅰ、Ⅱ、Ⅲと番号がふられ、ヒトのコラーゲンとしては2007年現在では28種知られています。
軟骨を構成するコラーゲンはⅡ型です。
真皮、靱帯、腱、骨、軟骨、基底膜等に存在しています。
ヒトの場合、Ⅰ型コラーゲンの量が圧倒的に多く、約95%です。他の型のコラーゲン全てを合わせても5%程度より存在しません。
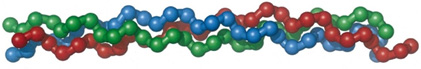
コラーゲンのペプチド鎖を構成するアミノ酸の配列は、―グリシン―アミノ酸X―アミノ酸Y― という規則性を有しており、グリシンが3残基ごとに繰り返しています。この配列は、コラーゲン様配列と呼ばれ、コラーゲンの特徴です。この1本のペプチド鎖はα鎖と呼ばれ、分子量は約10万ダルトンです。多くの型のコラーゲンでは、このペプチド鎖が3本集まり、お下げ髪を結うときのように撚られており、らせん構造を形成しています。このらせん構造をスーパーへリックスと呼んでいます。3本集まっているので、分子量は約30万ダルトンです。これがコラーゲンの構成単位であり、トロポコラーゲンと呼ばれています。
Ⅰ型コラーゲンの場合、トロポコラーゲンの長さは約290nm、太さは約1.5 nmです。
熱により3本のペプチド鎖がばらばらに解け、ゼラチンになります。このゼラチン状になることを、変性した、と言います。このゼラチン状になったトロポコラーゲンが、さらに分解したものがペプチドであり、最終的にはアミノ酸になります。元のトロポコラーゲンとは物理的にも、化学的にも大きく性質が異なります。
Ⅰ型コラーゲンは、アミノ酸配列上3個目ごとにグリシンが存在しています。従ってグリシンが3分の1を占めています。プロリン及びヒドロキシプロリンが約22%、アラニンが約11%という構成になっています。ヒドロキシプロリンはコラーゲンに特有のアミノ酸です。
一方Ⅱ型コラーゲンはグリシンの3分の1は変わりませんが、プロリン及びヒドロキシプロリンは約17%、アラニンが約9%と、やや低めになっています。
